北京时间10月1日消息,据国外媒体报道,诺贝尔生理学或医学奖刚刚揭晓! 2018年诺贝尔生理学或医学奖授予两位免疫学家:美国的詹姆斯·艾利森(James P。 Allison)与日本的庶佑(Tasuku Honjo) ,以表彰他们“发现负性免疫调节治疗癌症的疗法方面的贡献”。
癌症每年杀死的人多达成百上千万,是人类最大的健康挑战之一。今年的诺贝尔奖得主们通过激活人体自身免疫系统攻击肿瘤细胞的能力,发明了一种全新的癌症治疗原理。
在2018诺贝尔医学奖获得者做出这些发现之前,临床研究方面的进展一度较为缓慢。而“免疫检查点疗法”使癌症治疗取得了革命性突破,从根本上改变了我们对癌症治疗的看法。
2018诺贝尔生理学医学奖获得者詹姆斯·艾利森(James P。 Allison)对一种对免疫系统具有抑制作用的蛋白质开展研究。在这一过程中,他敏锐地意识到抑制这种蛋白质,从而发挥我们身体免疫系统去攻击癌细胞方面的潜力。在这一想法的基础上,他发展出一套针对癌症的全新疗法。
本庶佑是日本免疫学家,美国国家科学院外籍院士及日本学士院成员,目前在京都大学担任高等研究院特别教授。本庶佑本庶佑花了20年时间发现了T细胞表面受体PD-1抑制剂,这是一种针对免疫细胞的蛋白质,并揭示该蛋白可以作为一种抑制肿瘤的“刹车片”,与PD-1相关的免疫疗法新药效果显著,美国FDA已经核准了多种PD-1抗体试验新药,被认为是非常有效的治疗方法。
获奖人:
 美国免疫学家詹姆斯·艾利森(James P。 Allison)
美国免疫学家詹姆斯·艾利森(James P。 Allison)
James P allision, MD,他在德州大学奥斯汀分校获微生物学学士学位,后又获生命科学博士学位。他是美国国家科学院院士,霍华德·休斯医学研究所研究员。2014年获生命科学突破奖、唐奖生技医药奖、霍维茨奖、盖尔德纳国际奖、哈维奖、2015年获拉斯克临床医学研究奖。
 日本免疫学家Tasuku Honjo
日本免疫学家Tasuku Honjo
Tasuku Honjo(日语:本庶佑),日本免疫学家,美国国家科学院外籍院士,日本学士院会员。现任京都大学高等研究院特别教授。文化勋章表彰。文化功劳者。亚洲百大科学家。本庶教授因 PD-1、活化诱导胞苷脱氨酶的有关研究举世闻名,曾获得首届唐奖生技医药奖、京都奖以及华伦·阿波特奖等重要荣誉。
详细解读:
概述
每年,癌症在全球范围内杀死数百万人,这是人类所面临的最大健康风险之一。通过激发我们身体自身免疫系统的潜力,使其对癌细胞发起攻击的方式,今年的诺贝尔奖获奖人开创了全新的癌症诊疗手段。
詹姆斯·艾利森所研究的是一种蛋白质,这种蛋白质对于免疫系统具有抑制作用。他意识到,如果把这个“刹车片”进行暂时性的抑制,将可能释放我们身体免疫系统对癌细胞发起攻击的潜力。在此基础上,他发展出一套全新的癌症诊疗方案。
与此同时,本庶佑在免疫细胞表面发现了一种蛋白质,在对其功能进行了细致研究之后发现,这种蛋白质同样对人体免疫系统具有抑制作用,也是一块“刹车片”,只是作用的机制有所不同。基于他的发现建立的癌症疗法被证明极具效果。
我们身体的免疫系统可以被动员起来用于癌症治疗吗?
癌症种类繁多,但其本质是一样的,都涉及异常细胞的不受控增殖并侵袭健康器官和组织。目前已经有一些癌症治疗手段,包括手术,放疗以及其他手段,其中有些疗法的提出者已经被授予了诺贝尔奖。其中包括治疗前列腺癌的荷尔蒙疗法(Huggins,1966年获奖);化疗(Elion and Hitchin,1988年获奖);以及治疗白血病(血癌)的骨髓移植疗法(Thomas,1990年获奖)。然而,已经发展到晚期的癌症仍然缺乏有效诊疗手段,人类急需一种全新的癌症疗法。
19世纪末,20世纪初,有科学家提出,激发人体自身免疫系统的潜力,或许可以使其对癌细胞发起攻击。此后科学家们尝试过用细菌去感染病人,以试图激发起身体免疫系统反应。但这种做法效果十分有限,但这种策略的一种变相做法今天正被应用于对膀胱癌的治疗。人们意识到,我们对于自身的免疫系统抑制机制还缺乏了解。我们需要更多的知识。于是,很多科学家开始投身到与之相关的基础研究中,并揭示了人体免疫系统的基本调节机制,并弄清了免疫系统识别癌细胞的原理。但尽管取得了这样重要的进展,人类在开发一种广谱通用的癌症疗法的道路上依旧困难重重。
人体免疫系统的“刹车片”和“加速器“
人体免疫系统的一项基本功能是其能够识别“自己人”和“入侵者”。后者可能包括细菌,病毒或者其他外来威胁,他们将面临人体免疫系统的攻击和清除。T细胞作为血液内白细胞的一种,在这一防御体系内占据重要地位。T细胞拥有特殊受体,能够与那些“入侵者”表面的结构相结合,从而激发免疫系统的防御攻击。但另外还存在特殊的蛋白质,其功能是充当T细胞加速器,它可以触发全面免疫反应(见示意图)。
很多科学家在这项重要的基础研究中做出了贡献,他们还发现,有些蛋白质对于T细胞具有“刹车作用”,它们可以抑制人体的免疫反应。这种“加速器”和“刹车片”之间微妙的平衡关系非常关键。它的功能正常确保了人体免疫系统能够对抗入侵,但同时也不至于引发过度免疫反应对人体自身的健康器官和组织造成破坏。
免疫疗法的新原理
20世纪90年代,詹姆斯·艾利森在位于加州大学伯克利分校的实验室中研究T细胞蛋白CTLA-4。他是少数观察到CTLA-4具有T细胞“刹车”功能的科学家之一。其他研究团队探索了该蛋白质在自体免疫疾病的治疗中作为目标的机制。然而,艾利森具有完全不同的想法。他已经开发了一种可以结合到CTLA-4并抑制其作用的抗体。现在,他开始研究CTLA-4的阻断作用能否松开T细胞的“刹车”功能,并促使免疫系统攻击癌细胞。艾利森和同事在1994年底进行了第一次实验,并在圣诞节期间再一次获得了成功。结果非常令人惊喜。利用能抑制“刹车”并解开抗肿瘤T细胞活性的抗体,他们治愈了患有癌症的小鼠。尽管来自制药业的关注极少,但艾利森依然努力开发该疗法在人类身上的应用。多个研究团体很快获得了理想的结果,到2010年,一项重要的临床研究显示,该疗法对晚期黑色素瘤效果显著。在一些患者中,还出现了癌症残留消失的迹象。此前,在黑色素瘤患者群体中还从未出现过如此显著的结果。
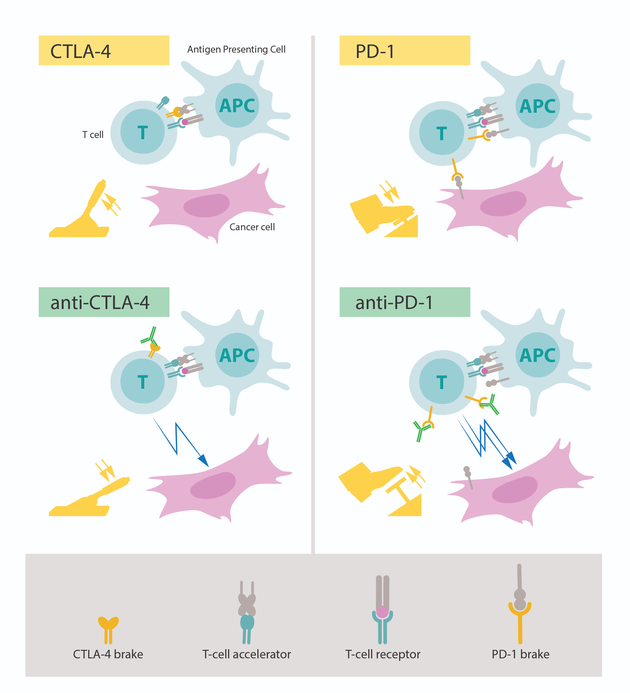 图片左上角:T细胞激活需要T细胞受体与被识别为“非自体(non-self)”的其它免疫细胞结合在一起,T细胞激活也需要一种蛋白质作为T细胞的加速器。CTLA-4的功能是T细胞的制动器,可以抑制T细胞加速器的功能。 图片左下角:图中绿色部分是抗体,阻断了CTLA-4的制动功能,可以激活T细胞,并攻击癌症细胞。 图片右上角:PD-1是另一种T细胞制动器,可以抑制T细胞激活。 图片右下角:抗体抑制PD-1,抑制了T细胞激活制动功能,并且能够高效攻击癌症细胞。
图片左上角:T细胞激活需要T细胞受体与被识别为“非自体(non-self)”的其它免疫细胞结合在一起,T细胞激活也需要一种蛋白质作为T细胞的加速器。CTLA-4的功能是T细胞的制动器,可以抑制T细胞加速器的功能。 图片左下角:图中绿色部分是抗体,阻断了CTLA-4的制动功能,可以激活T细胞,并攻击癌症细胞。 图片右上角:PD-1是另一种T细胞制动器,可以抑制T细胞激活。 图片右下角:抗体抑制PD-1,抑制了T细胞激活制动功能,并且能够高效攻击癌症细胞。
PD-1的发现及其对癌症治疗的重要性
1992年,在詹姆斯·艾利森取得发现之前,本庶佑发现了PD-1。这是另一种在T细胞表面表达的蛋白质。为了揭示这种蛋白质的作用,本庶佑在京都大学的实验室中进行了一系列精巧的实验。结果显示,与CTLA-4类似,PD-1也具有作为T细胞“刹车”的功能,但作用机制完全不同。正如本庶佑和其他研究小组揭示的那样,PD-1阻断在动物实验中被证明是一种非常有前景的抗癌策略。这为利用PD-1治疗癌症患者的目标铺平了道路。临床开发随之而来,2012年的一项重要研究表明,该疗法对不同类型的癌症患者疗效显著。结果非常具有戏剧性,几位患有远端转移癌症的患者出现了长期缓解甚至治愈的迹象,而这样的疾病此前被认为是不能治愈的。
免疫检查点疗法的今天和未来
自研究显示CTLA-4 和 PD-1抑制剂的治疗效果以来,临床研究取得了巨大进展。如今我们知道,这种常被称作“免疫检查点疗法”的治疗方法已经使一些特定癌症晚期患者的治疗结果发生了根本性的改变。和其它癌症疗法类似,这种疗法也存在一定副作用,有时会很严重、甚至危及患者生命。这些副作用是由过度活跃的免疫反应引发自体免疫反应导致的,但一般都可以得到控制。有大量相关研究试图弄清该疗法的作用机制,从而进一步改进该疗法、减少副作用。
在两种治疗策略中,针对PD-1的检查点疗法被证明疗效更好,且在肺癌、肾癌、霍奇金淋巴瘤和黑色素瘤等癌症的治疗中都取得了积极成果。最新临床研究显示,若能将针对CTLA-4和PD-1的两种疗法结合,疗效还会进一步加强。这点已在黑色素瘤患者身上有所体现。因此,受到艾利森和本庶佑的研究启发,科学家尝试将不同松开免疫系统“刹车片”的方法相结合,希望能更高效地铲除癌细胞。目前已有多项针对大多数癌症的检查点疗法正在开展临床试验,还有新的检查点蛋白质正在作为目标接受测试。
100多年来,科学家一直试图将免疫系统整合到癌症治疗中。但在2018诺贝尔医学奖获得者做出这些发现之前,临床研究方面的进展一直较为缓慢。“免疫检查点疗法”使癌症治疗取得了革命性突破,从根本上改变了我们对癌症治疗的看法。
责任编辑:林晗枝
特别声明:本网登载内容出于更直观传递信息之目的。该内容版权归原作者所有,并不代表本网赞同其观点和对其真实性负责。如该内容涉及任何第三方合法权利,请及时与ts@hxnews.com联系或者请点击右侧投诉按钮,我们会及时反馈并处理完毕。
- 电商出口免税新规怎么回事?电商出口免税新规出炉有什么好处2018-10-01
- 马云弃阿里所有权怎么回事?马云弃阿里所有权背后真相是什么2018-10-01
- 马云弃阿里所有权什么情况?马云为什么放弃阿里所有权详情被曝光2018-10-01
- 滴滴封禁马甲车原因是什么?马甲车是什么滴滴为什么要封禁它2018-10-01
- 滴滴封禁马甲车怎么回事?滴滴整改情况如何了详情曝光2018-10-01
- 最新科技资讯 频道推荐
-

华为今年推出全球首款5G手机 华为折叠屏手机2018-10-01
- 进入图片频道最新图文
- 进入视频频道最新视频
- 一周热点新闻



















